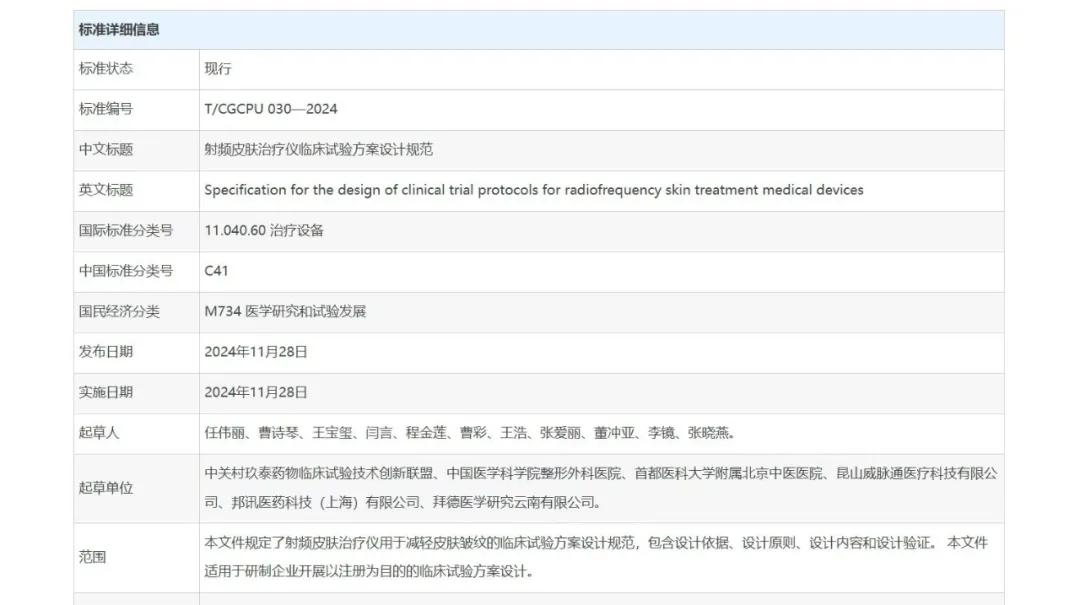
11月28日,《射頻皮膚治療儀臨床試驗方案設計規范》正式發布實施,標準標號為T/CGCPU 030-2024。該規范由中關村玖泰藥物臨床試驗技術創新聯盟提出,聯合中國醫學科學院整形外科醫院、YOUMAGIC研發公司(昆山威脈通醫療科技有限公司)等多家單位共同起草制定。此團體標準的發布標志著我國射頻醫療行業向合規化、標準化邁出了重要一步。

國內首個射頻臨床團體標準發布,為行業創新提供合規化指引
隨著人們對抗衰老和變美需求日益增加,射頻技術以非入侵、療效顯著、副作用低及廣泛的適用性,贏得了廣大消費者的青睞,也驅動著諸多企業投身于此類產品的研發與注冊。另外隨著國家對于醫用治療設備的監管要求日趨完善,行業規范性發展全面提速,進入“械字號”新時期。在此背景下,行業急需一套聚焦射頻皮膚治療儀的臨床試驗方案設計要求,以規范此類設備的研發與臨床應用,推動行業合規和進步。
然而目前,盡管國家藥監局器審中心已發布《射頻美容設備注冊審查指導原則》(2023年第8號),但在具體的臨床研究指導原則方面尚屬空白。面對合規及標準化需求的緊迫性,YOUMAGIC及研發公司威脈醫療作為行業“先行軍”,正發揮自身的技術實力和主觀能動性,賦能行業健康發展。
事實上,憑借在射頻皮膚治療領域的深厚積累,YOUMAGIC已率先完成了高能單極射頻產品的臨床試驗,有序開展了動物實驗、仿真實驗、離體實驗及臨床試驗等相關試驗,并成功獲批國內首張NMPA三類醫療器械證。

依托在臨床試驗方面的豐富經驗以及多年深耕行業的積累,YOUMAGIC及研發公司威脈醫療為此次團體標準的制定提供了關鍵的標準依據和理論支持,為行業規范化、和整體研發水平提升給與了關鍵指引。
構建全面科學可操作的規范框架,推動行業標準化
據悉,《射頻皮膚治療儀臨床試驗方案設計規范》旨在統一臨床試驗操作、數據處理、有效性評價、風險防控等關鍵環節,為射頻皮膚治療儀臨床試驗構建一個全面、科學且可操作性強的規范框架。
該團體標準基于《藥物臨床試驗質量管理規范》、《醫療器械產品臨床試驗設計指導原則(2018年第6號)》及《醫療器械臨床試驗質量管理規范(2022年第28號)》等權威文件,結合射頻類皮膚治療儀的應用原理、產品特性和臨床應用需求,制定了詳盡的臨床試驗方案設計規范,適用于研制企業開展以注冊為目的的臨床試驗方案設計。

相關規劃遵循“科學性、實用性、獨立性、規范性、可操作性”的原則,在設計依據、原則、內容、驗證等方面,全方位、多層次地規范了射頻皮膚治療儀的臨床試驗方案設計流程。為行業內相關臨床研究質控提供了統一標準,推動行業的進步、持續創新以及高質量發展。
深化醫工結合研發路徑,助力產業向健康可持續發展進階
作為《射頻皮膚治療儀臨床試驗方案設計規范》的主要起草者之一,該團體標準的發布,也是YOUMAGIC及研發公司威脈醫療重視科研、注重標準的體現。據悉,團隊深度參與多種標準的編制工作,并結合自身研發和臨床試驗經驗,提供了堅實的臨床技術、臨床研究標準和策略指導,助力行業臨床研究提質增效。
未來,YOUMAGIC及研發公司威脈醫療將繼續深化醫工結合研發路徑,不斷貫徹落實國務院《國家標準化發展綱要》的核心精神,進一步參與和構建行業內臨床試驗領域的標準化體系,充分激活團體標準在引領臨床試驗向更高質量躍進中的關鍵效能,不斷為市場發展注入創新活力。
可以預見,隨著這一團體標準的深入實施和不斷完善,行業將邁入高質量發展階段,為消費者帶來更多前所未有的品質體驗,推動產業走向更加合規、健康、可持續的發展道路。






